Пересадка мезенхимальных клеток (МСК) для лечения коронавируса
В on-line версии журнала «Гены и Клетки» опубликован обзор на актуальную тему «Клеточная трансплантация в программе лечения covid-19: пересадка стволовых стромальных (мезенхимальных) клеток».
Текущий 2020 год – юбилейный для журнала «Гены и Клетки». 15 лет назад, в 2005 году было принято решение издавать системный, качественный, профессиональный журнал, посвященный нарождающейся области биомедицины – клеточной трансплантологии и тканевой инженерии.
Благодаря высококачественной экспертизе рецензентов, работе редакторов, благодаря редакционной политике, качественным публикациям авторов, всегда уделявших внимание самым актуальным вопросам генных и клеточных технологий, издание «Гены и Клетки» практически все это время рекомендовано ВАК для опубликования основных результатов научных исследований; часть пройденного пути журнал индексируется SCOPUS и входит в Q3 по тематике «трансплантология».
Введение
Пересадка клеток для коррекции ургентных состояний, не связанных с гематологической практикой и нейропротекцией, остается малоизученной областью трансплантологии. В научной литературе имеется небольшой пул статей, посвященных этому методу при лечении перитонита, панкреонекроза, сепсиса, ДВС-синдрома. Синдром острого диффузного альвеолярного повреждения как ниша для применения возможностей пересадки дискретных клеток – относительно новая область исследований.
Одним из существенных оснований к инициации таких работ были эпидемические вспышки коронавирусного тяжелого острого респираторного синдрома (ТОРС; Severe Acute Respiratory Syndrome, SARS) 2002 (SARS-CoV) и 2012 (Middle East Respiratory Syndrome, MERS) годов. Пандемическое распространение тяжелого острого респираторного синдрома коронавирусной этиологии – COVID-19, которое человечество переживает в настоящий момент, также актуализировало указанное направление исследований.
По предварительным данным, у значительной части заболевших инфекция протекает в бессимптомной форме (1-18%) или со стертой клинической картиной. У 80% развиваются признаки клинически значимого поражения легких и дыхательная недостаточность. Только у 15-42% процесс взаимодействия вируса и макроорганизма приводит к диффузному альвеолярному повреждению в виде острого респираторного дистресс синдрома (ОРДС) с явлениями полиорганной недостаточности и угрожающим прогнозом. ОРДС протекает у больных в легкой (36%), средней (45%) и тяжелой форме (19%), что обусловливает общее распределение клиники SARS-CoV-2 на группы средней тяжести (80%), тяжелую (14%) и группу больных с критическим течением (5%). Пока не опубликованы достоверные статистические данные об эффективности перевода пациентов на инвазивную искусственную вентиляцию легких, однако ясно, что значительная часть из них не выздоравливает, а погибает; используемые в практике методы их лечения и поддержки оказываются неэффективными. Несмотря на то, что в структуре исходов заболевания на смерть приходится небольшая доля – около 2,3%* (от общего числа заболевших), однако в абсолютных цифрах в связи с пандемическим характером распространения инфекции, такие больные исчисляются десятками тысяч; что и обусловливает высокую степень актуальности разработки и подбора новых эффективных средств лечения. Причем, следует учитывать, что по оценкам исследователей около 86% инфицированных остаются неучтенными в публикуемой статистике.
Прежде чем приступить к анализу накопленной к сегодняшнему дню информации, необходимо последовательно оценить потенциальные звенья-мишени в патоморфогенезе COVID-19 в отношении которых могут быть эффективны живые клеточные препараты.
Патоморфогенез COVID-19
В течение острой коронавирусной инфекции предложено выделить три фазы: 1 – фаза ранней инфекции, проявляющаяся лимфоцитопенией, эозинопенией и неспецифическими клиническими симптомами ОРВИ; 2 фаза – легочная; 3 фаза – «гипервоспаление» с повреждением большинства внутренних органов и нарастанием полиорганной недостаточности или в эту фазу происходит выздоровление.
Согласно имеющимся представлениям, полученным по результатам экспериментальной, клинической и аутопсийной работы, при развитии ТОРС основным местным эффектом возбудителя в легких является прямое цитопатическое действие, проявляющееся т.н. диффузным альвеолярным повреждением (ДАП). В развитии ДАП существенную роль также играет и атака аутореактивными плазматическими клетками на инфицированные эпителиоциты легкого.
Установлено, что в первый период повреждения легких вирус проникает как в альвеолоциты, так и в макрофаги и лейкоциты (макрофаги и лимфоциты). Имеющиеся сегодня данные позволяют считать, что тропность вируса к клеткам определяется прежде всего распределением рецепторов АСЕ2. Установлено, что большое количество этих молекул экспрессировано на альвеолоцитах II типа, эндотелиоцитах, почечном эпителии и др. Важно, что рецептор ACE2 не обнаружен по крайней мере на некоторых Т- и В- лимфоцитах и макрофагах. Вместе с тем, описаны дополнительные клеточные рецепторы, способствующие проникновению вируса в клетку. Одним из них служит протеаза TMRRSS2. Также альтернативным рецептором является СD147 и, возможно, рецепторы сиаловой кислоты. Таким образом, выявлено не менее четырех молекулярных рецепторов, опосредующих внутриклеточное проникновение вирусных частиц. Характерно, что вся совокупность рецепторов описана в эндотелии, что делает его наиболее реактивной по отношению к COVID-19 тканью. Экспериментально показано, что блокировка некоторых рецепторов способна ограничить проникновение вируса в клетку.
Попадание коронавируса в некоторые лейкоциты, а именно – в моноциты, макрофаги и дендритные клетки, приводит к выработке ими мощного провоспалительного цитокина IL-6 и ряда других молекул, активирующих воспалительный ответ. Как известно, IL-6 взаимодействует со своим рецептором по молекулярным путям т. н. цис- или транс- сигнализации. Результатом первого является активация звеньев приобретенного (T- и B-лимфоцитов) и врожденного (NK-клетки) иммунитета и нейтрофилов (рис. 1), при этом установлено снижение функциональной активности Т-регуляторных лимфоцитов.

Рис. 1. Схема одного из звеньев патоморфогенеза COVID-19: IL – интерлейкин; NK – естественные киллеры; VEGF – эндотелиальный сосудистый фактор роста; МСР – моноцитарный хемоаттрактивный белок.
Взаимодействие IL-6 со своим растворимым рецептором (IL-6R) в сосудистом русле влечет за собой активацию транс-сигналинга в отношении клеток, не имеющих собственных рецепторов к нему – эндотелиоцитов. Вовлечение эндотелиальной выстилки кровеносного русла приводит к ярким системным проявлениям в виде т. н. «цитокинового и хемокинового шторма»: происходит выработка эндотелиального сосудистого фактора роста, IL-8, моноцитарного хемоаттрактивного белка-1 (MСP-1), выделение ферритина CD163-положительными макрофагами. Важно, что при этом снижается экспрессия белков межклеточных контактов – кадгеринов; в том числе и в эндотелиоцитах, что обуславливает активную экссудацию в этот период болезни, формирование альвеолярного и интерстициального отека, значимо ухудшающего газообмен как в ходе внешнего, так и в ходе тканевого дыхания. Реализация транс- пути сигнализации приводит к повышению активности T-хелперов. Диссеминация зараженных лейкоцитов по организму способствует вовлечению в патологический процесс многих структур, включая эндотелий, органы иммунной системы, что обусловливает иммунодеплецию, органы ЖКТ, почки, сердце, мышечную ткань, головного мозга и др. По понятным причинам наилучшим образом такая диссеминация коронавируса изучена на примере SARS-CoV.
Ряд авторов указывают, что формирующаяся картина патогенеза может быть обозначена как вторичный гемофагоцитарный лимфогистиоцитоз и коррелирует с неблагоприятными исходами. Получены первичные данные о положительной роли антагонистов IL-6-IL6R-пути (тоцилизумаб) для купирования «цитокинового шторма».
Под воздействием вируса и в результате иммуноопосредованной атаки цитотоксическими лимфоцитами и макрофагами существенно изменяются структура и свойства альвеолярной стенки, а именно: погибает и десквамируется легочный эпителий, повреждаются эндотелиоциты, что совокупно создает предпосылки к просачиванию богатой белком жидкой части крови в просвет альвеол. Испарение в ходе дыхания приводит к осаждению на альвеолярной поверхности белковых преципитатов, которые постепенно уплотняются и формируют т. н. «гиалиновые мембраны». Эта экссудативная фаза ДАП продолжается 10-14 дней. Указанные изменения вместе с реакцией интерстициального воспаления, эффекторами которого выступают альвеолярные макрофаги, составляют морфологический субстрат тяжелого ДАП – острого респираторного дистресс-синдрома (взрослых). Купирование последнего является трудноразрешимой медицинской задачей; в контексте настоящего краткого сообщения мы обратим внимание только на потенциальную роль клеточной терапии, которую следует рассматривать только как элемент комплексного лечения.
Патоморфологами в дополнение к вышесказанному описана гигантоклеточная реакция в легких. Установлено, что часть гигантских многоядерных клеток являются результатом слияния макрофагов, а часть – результатом объединения альвеолоцитов в симпласт. Установлено, что бронхиальный эпителий при ТОРС может подвергаться «плоскоклеточной метаплазии».
Продукты экссудации в альвеолы являются благоприятным субстратом для присоединения вторичной инфекции особенно на фоне терапии кортикостероидами: описано присоединение к ТОРС Аspergillus sp., Mucor sp., Pseudomonas aeruginosa, Klebsiella sp., Staphylococcus aureus, α-hemolytic Streptococcus sp., Сytomegolavirus.
Авторы утверждают, что патоморфологичекие признаки ТОРС не являются специфичными и достоверных признаков, позволяющих отличить ДАП в зависимости от различных этиологических факторов, включая повреждение инфекционными агентами, кислородом и др. – нет.
В случае разрешения ДАП продукты транссудации в альвеолу и гиалиновые мембраны частично резорбируются клетками макрофагального звена, а частично остаются в качестве субстрата для организации и развития последующего фиброза легких. Показана прямая корреляция между длительностью ДАП и тяжестью развивающегося в последующем пневмофиброза (рис. 2).

Рис. 2. Схема местного (легочного) звена патоморфогенеза SARS-CoV-2.
Внелегочные поражения, вызванные вирусом COVID-19
Многими авторами показано, что второй по значимости мишенью для вируса является эпителий желудочно-кишечного тракта, в частности – кишечника, печени. Так, диарейный синдром определяется у больных в 67-70% случаев. Однако, исследователям не удалось выявить специфические черты вирусного повреждения; в основном они сводятся к дистрофическим, некротическим повреждениям, иногда – развитию апоптоза.
Повреждение почечного эпителия проявляется в виде некроза, что на органном уровне приводит к развитию острого тубулярного некроза вследствие прямого цитопатического действия. Также неспецифические признаки повреждения зарегистрированы при исследовании лимфатических узлов, селезенки, ЦНС (нейронов), скелетной и сердечной мускулатуры, щитовидной железы и семенников.
При проведении аутопсии могут быть обнаружены некрозы селезенки, запустевание лимфоидной ткани. При исследовании костного мозга в некоторых случаях зарегистрировано снижение клеточности, однако без выяления вирусных частиц в его клетках.
Важной мишенью вируса являются структуры сердечно-сосудистой системы; помимо эндотелия, это прежде всего клетки миокарда. Поскольку вирус опосредует свое влияние путем утилизации рецепторов АСЕ2, служащих важным компонентом поддержания артериального давления в сигнальном каскаде ренин-ангиотензин-альдестроновой системы, то прямая и опосредованная утилизацией АСЕ2 коронавирусом активация рецептора ангиотензина II AT-1R через АСЕ1 приводит к вазоконстрикции, усилению воспаления, индукции кардиофиброза, поддержанию АРДС и другим неблагоприятным эффектам. Что, по-видимому, напрямую влияет на неблагоприятные исходы у коморбидных пациентов с патологией сердечно-сосудистой системы.
Таким образом, при развертывании патоморфогенеза ТОРС вообще и COVID-19 в частности имеются как минимум четыре патогенетические ниши для применения методов клеточной трансплантации: купирование острого тяжелого альвеолярного повреждения в том числе его аутоиммунного компонента, профилактика или снижение выраженности «цитокинового и хемокинового шторма», снижение вероятности диссеминации вируса в клетках фагоцитарного звана и лимфоцитах, профилактика отдаленных легочных осложнений в виде фиброза (рис. 3). Исследователи подчеркивают возможное предотвращение фиброза легких в отсроченном периоде, несмотря на принадлежность МСК к категории клеток-предшественниц стромальных клеток, т.е. конституциональных «коллагенобластов».
Очевидно, что научные группы, специальным образом сосредоточенные на вопросе клеточной терапии заболеваний легких предложат более детализированное представление о мишенях для клеточной пересадки с целью коррекции легочных и внелегочных проявлений коронавирусной инфекций.
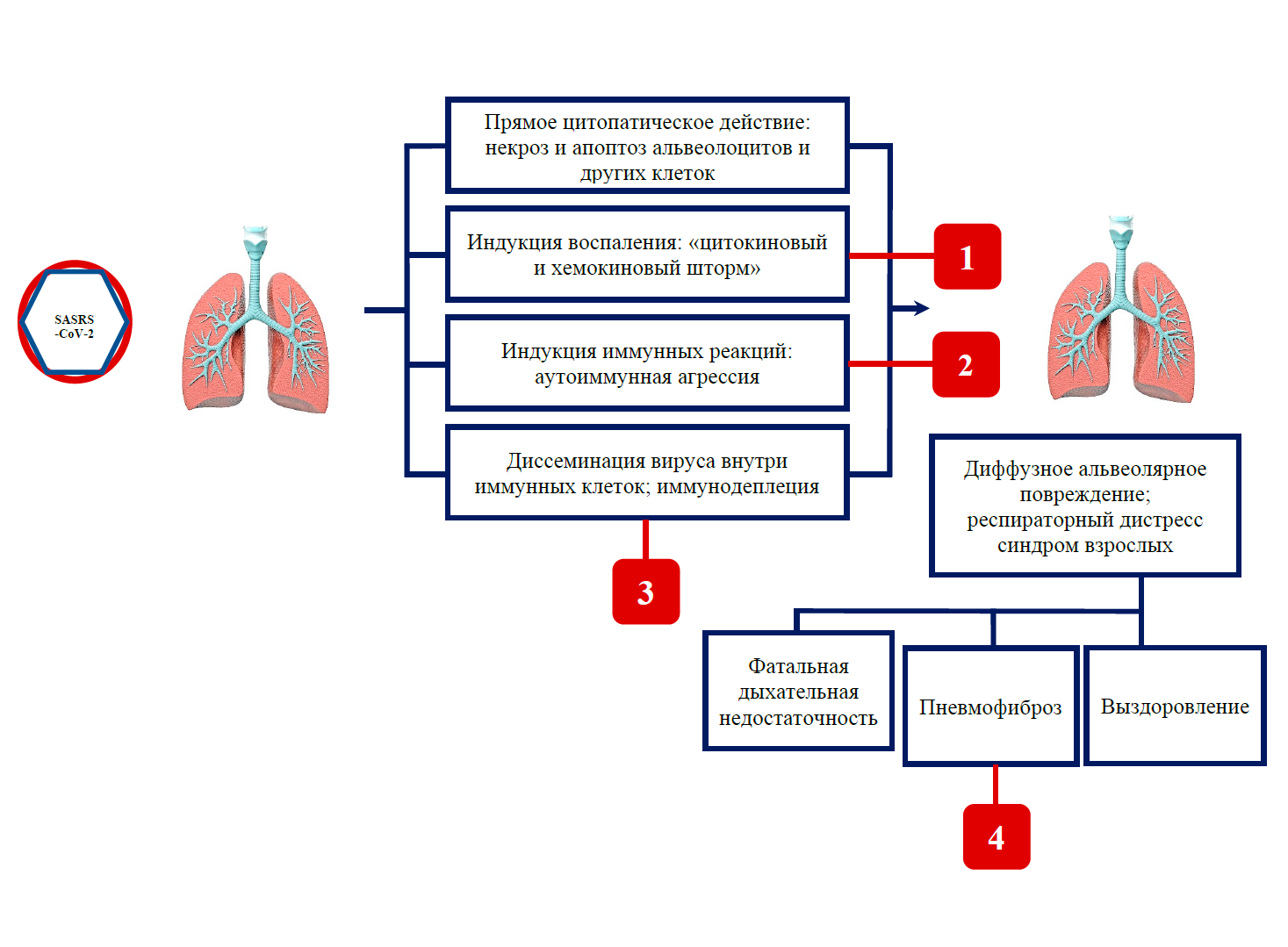
Рис. 3. Потенциальные мишени клеточной терапии: 1 – снижение выраженности «цитокинового и хемокинового шторма»; 2 – снижение выраженности аутоиммунного компонента патогенеза; 3 – предотвращение заражения иммунных клеток и их диссеминации; 4 – профилактика пневмофиброза
Применение пересадки стволовых мезенхимальных (стромальных) клеток (МСК)
Теоретические и экспериментальные основы этого вида лечебного воздействия при ДАП были разработаны в первом десятилетии текущего века. Считается, что в основе положительного влияния МСК в отношении развития воспалительного процесса в легких и пневмофиброза лежат как потенциально возможная и показанная в эксперименте трансдифференцировка в альвеолоциты, так и паракринное влияние пересаженных МСК на ткани. Последний механизм исследователи считают доминирующим (рис. 4).
Выявлено, что МСК могут проявлять несколько направлений паракринных эффектов, а именно снижать выраженность экссудации и воспаления за счет опосредованного ингибирования синтеза провоспалительных цитокинов и матриксных металлопротеаз, активации выработки противовоспалительных цитокинов. Показано слабое противомикробное действие этих клеток; формирование особых межклеточных способов взаимодействия с клетками реципиентного ложа, за счет микровезикулярного сигналинга и формирования непосредственных межклеточных контактов в виде цитоплазматических мостиков с трансфером митохондрий и др.
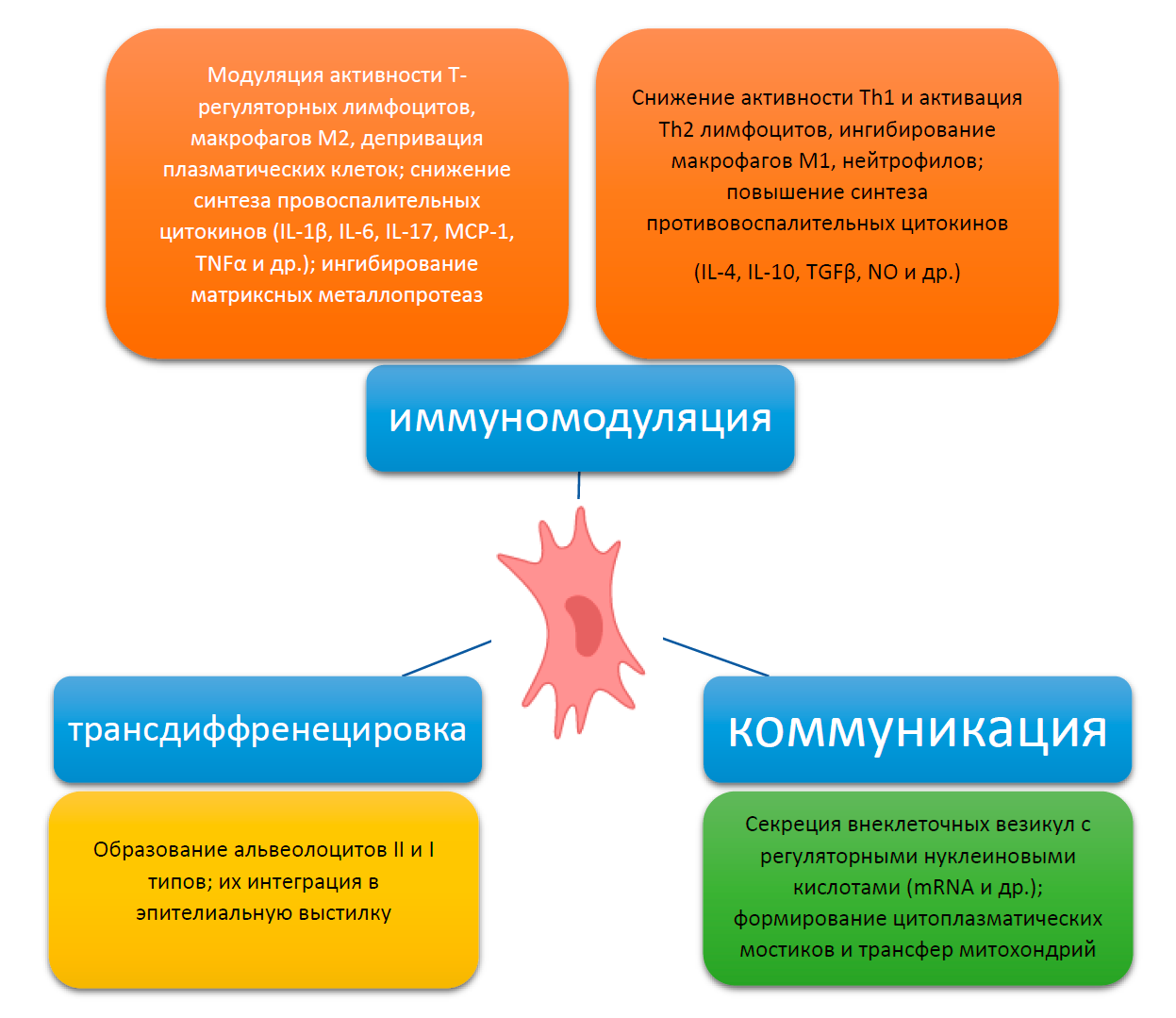
Рис. 4. Схема посттрансплантационной активности МСК.
Эффекты МСК в отношении легочной патологии, в том числе вирусной этиологии изучены и систематизированы в обширных сводках. Установленные факты позволили постулировать потенциальные выгоды от трансплантации МСК за счет их противовоспалительной, иммуномодулирующей, регенераторной (что бы это ни значило), проангиогенной и антифиброзной активностей. Считается, что МСК из онтогенетически «ранних» тканей, например – пупочного канатика, обладают рядом преимуществ, в частности минимальной экспрессией MHC.
Доклинические и клинические исследования в отношении клеточной терапии ОРДС различной этиологии не отличаются многочисленностью. Фактически все они предполагают применение аллогенных МСК. Клинические исследования, проведенные или проводимые сейчас систематизированы в таблице. Обращает внимание, что первые научные исследования реализованы в начале второго десятилетия текущего века и, в немалой степени, были обусловлены эпидемическими вспышками атипичной пневмонии коронавирусной инфекции. К сожалению, результаты исследований первой волны не были должным образом проанализированы и опубликованы в научной периодике, имеется лишь несколько сообщений на этот счет. Пока можно утверждать, что пересадка аллогенных МСК безопасна у таких пациентов в дозах несколько миллионов на кг массы тела, серьезные нежелательные явления, регистрируемые в исследованиях, не связывают с пересадкой МСК; однако регистрируемый клинический эффект характеризуют как «слабый». Представления о наиболее целесообразных режимах введения клеток и влияния на исход и течение ОРДС должны дать клинические протоколы, реализуемые сейчас.
В текущий период развития этой технологии специалисты рассматривают клеточную терапию как способ поддержать тех пациентов, чье клиническое течение характеризуется плохим прогнозом: вероятность летального исхода при современных способах лечения при развитой картине ОРСД достигает 60%. Апробируются достаточно большие количества вводимых клеток – 1-10×106 на кг массы тела пациента. При такой «дозировке» оправданным выглядит применение клеток из аллогенных источников, наименее востребованными из которых на сегодняшний день были пупочный канатик и пульпа зуба. Кроме небрендированных клеточных продуктов в исследования вовлечено и применение клеточных препаратов, в частности, 1 фазу проходит продукт NestCell®; исследование проводится бразильской CRO Azidus Brasil Scientific Research and Development Ltd. (см. табл.).
Часть результатов пилотных исследований уже опубликованы, однако они носят характер демонстрации клинических случаев и пока не позволяют сделать выводы о безопасности и признаках эффективности. Авторы высказываются о необходимой осторожности в трактовке полученных результатов. Вместе с тем, разработанные протоколы не длительные по исполнению, в том числе исходя и из особенностей ОРДС, поэтому обобщенных результатов 1-2 фаз исследований можно ожидать уже в этом году.
В России, как и в остальных странах, доклинические и клинические исследования клеточной терапии легочной патологии не являются мейнстримом. Тем не менее, первые экспериментальные работы были опубликованы коллективом под руководством РК. Чайлахяна и А.В. Аверьянова на рубеже первого и второго десятилетий этого века. Авторам удалось получить данные о влиянии культур МСК на протекание липополисахарид-индуцированного острого повреждения легких и пневмофиброза у экспериментальных животных – крыс и кроликов. В дальнейшем, авторы сосредоточились на поведении клинических исследований по коррекции эмфиземы при помощи аллогенных МСК. Однако, судя по всему, результаты исследования оказались противоречивыми, в связи с чем не опубликованы в полном виде. Указанная научная группа рассматривает МСК как один из потенциальных терапевтических агентов для профилактики и лечения легочного фиброза различной этиологии.
Кроме применения МСК, врачи рассматривают включение в инфузионную терапию у тяжелых больных с ОРДС и другие агенты клеточной терапии. В частности, реализацию адоптивной иммунотерапии с применением Т-лимфоцитов и NK-клеток, а также некоторых других (см. табл.).
Заключение
Таким образом, в связи с развивающейся пандемией COVID-19 вопрос применения дополнительных средств лечения в виде клеточной терапии стал одним из самых актуальных и востребованных. В научной периодике и общественном пространстве уже появлялись призывы исследователей к национальным регуляторам обратить внимание на остроту проблемы и обеспечение «fast track» инициации клинических исследований в данной области, при соблюдении принципов безопасности и достоверности.
Настоящий краткий обзор по проблемам патоморфогенеза и испытаний методов клеточной трансплантации для лечения жизнеугрожающего ТОРС следует рассматривать как приглашение научных групп к началу исследований в области геномики, протеомики коронавирусной инфекции, разработки генопосредованных, цитокиновых и клеточных препаратов, направленных на борьбу с вирусом и неблагоприятными клеточными и тканевыми реакциями, развивающимися в результате взаимодействия вируса и макроорганизма.
ТАБЛИЦА
Основные клинические исследования по лечению ОРДС (в том числе вирусной этиологии) при помощи клеточной терапии




